Tanto a produção quanto a secreção de GH-hormônio de crescimento são estimuladas pelo hormônio de liberação de GH hipotalâmico (GHRH) e pela grelina endógena secretagogos de GH (GHS), um produto das células oxínticas localizadas dentro do fundo do estômago. A grelina e o GHRH atuam em sinergia para estimular a secreção de GH-hormônio de crescimento quando administrado “in vivo”, mas que atuam de forma aditiva quando incubadas com somatotrófos “in vitro”. A grelina também é encontrada dentro do núcleo hipotalâmico arqueado, onde ele pode aumentar a liberação de GHRH e prejudicar a produção de somatostatina que (SRIH) contribui assim para a sua sinergia com GHRH. A grelina é um peptídeo orexígenos, bem como um GHS (estimulador de GH-hormônio de crescimento) e parece desempenhar um papel importante no metabolismo da energia.
A produção de somatostatina SRIH inibe a secreção, mas não a síntese de GH-hormônio de crescimento e de forma mais eficaz que estimulada por GHRH do que pela grelina. O GHRH também aumenta a taxa de crescimento linear eficaz em crianças com DGH – deficiência de hormônio de crescimento, mas é menos eficaz do que o GH. A descoberta de peptidilo e não-peptidilo secretagogos de GH-hormônio de crescimento (que precedeu e levou à identificação de si pela grelina) apresenta ainda outros agentes para a estimulação da secreção de GH-hormônio de crescimento endógeno, que têm sido úteis em estudos de diagnóstico para DGH – deficiência de hormônio de crescimento e para o seu tratamento em pequenos grupos de indivíduos. É provável que o GH e seus secretagogos sejam de crescente utilidade clínica nas próximas décadas.
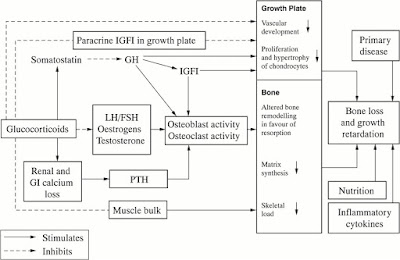
A alteração na expressão destas isozimas 11beta-HSD em tecidos periféricos modifica a ação de corticóide: perda de atividade de 11beta-HSD2 no rim os resultados são induzidos por excesso de cortisol, mineralocorticóides, e perda de atividade de 11beta-HSD1 hepática melhora a sensibilidade à insulina através de uma redução em cortisol-gliconeogênese induzida e produção de glicose hepática. Por outro lado, sobre expressão de 11beta-HSD1 no tecido adiposo omental pode estimular a diferenciação de adipócitos induzidos por glicocorticóides, que podem levar à obesidade central, que é uma patologia grave. Os pacientes com hipopituitarismo têm muitas características clínicas em comum com pacientes com síndrome de Cushing - obesidade visceral, nomeadamente a resistência à insulina, osteoporose e mortalidade vascular aumentada. Como avaliado por cortisol livre urinário/rácios de cortisona (Rácios técnicos, que procuram relevar aspectos relacionados com a produção e a atividade em geral e se expressam normalmente em unidades físicas) livres urinários e aprovados através de estudos “in vitro”, nem GH-hormônio de crescimento, nem o fator de crescimento semelhante à insulina-1 (IGF)-1 afetam a atividade da 11beta-HSD2.
Por outro lado, os pacientes com DGH-hormônio de crescimento no ajuste do hipopituitarismo demonstram um aumento/rácios de cortisol e redução de metabolito de cortisona na circulação de concentrações de cortisol em pacientes com a substituição de hidrocortisona. O tratamento com reposição de GH-hormônio de crescimento em dose baixa inverte essas anormalidades. Estes dados sugerem que o GH-hormônio de crescimento clínico (e/ou IGF-1) inibe de 11beta-HSD1 (isto é, conversão E a F) isozimas interconvertem hormonalmente cortisol ativo (F) e cortisona inativa (E). (Paralelo nos estudos “in vitro” sugerem que o IGF-1 e o GH não inibem a 11beta-HSD1). Estes resultados têm implicações clínicas importantes:
1) O aumento GH-hormônio de crescimento mediado pelo metabolismo do cortisol (mediado via redução de cortisona inativa E e a conversão cortisol ativo F) pode precipitar a insuficiência adrenal em pacientes com hipopituitarismo com deficiência de hormônio adrenocorticotrófico parcial ao iniciar a terapia com GH-hormônio de crescimento.
2) Muitas das características fenotípicas do hipopituitarismo por DGH pode ser explicadas por uma alteração na atividade de 11beta-HSD1: a DGH aumenta eficazmente a produção de cortisol em tecidos-alvo chave, incluindo fígado e tecido adiposo, resistência à insulina e promove a adiposidade visceral, esta característica é muito comum e é um fator de diagnóstico diferencial.
3) Os efeitos benéficos relatados de GH-hormônio de crescimento sobre fatores de risco cardiovascular em pacientes com hipopituitarismo podem ser um efeito indireto através de alterações no metabolismo do cortisol que nessas condições está diminuída, esse fator é extremamente útil em pacientes com esse comprometimento por ser um órgão chave.

Finalmente, o GH/IGF-1 fazem a modulação do metabolismo de cortisol e pode sustentar a patogênese das doenças comuns, tais como a obesidade central e osteoporose idiopática.
Pacientes com obesidade central, mas sem evidência de hipopituitarismo tem deficiência relativa GH-hormônio de crescimento é espetacularmente emocionante que o tratamento com GH-hormônio de crescimento de baixa dose neste grupo, através da inibição da geração de cortisol dentro de gordura omental, pode oferecer uma nova abordagem terapêutica extremamente importante. Em outras palavras, a conclusão é que a cortisona e o cortisol interferem negativamente no desenvolvimento estatural devido ao seu comprometimento antagônico entre si, ou seja, cortisol e GH – hormônio de crescimento/IGF-1. Portanto, esses fatores não afetarão apenas pessoas em desenvolvimento, mas também adultos de forma perene.
Dr. João Santos Caio Jr.
Endocrinologia – Neuroendocrinologista
CRM 20611
Dra. Henriqueta V. Caio
Endocrinologista – Medicina Interna
CRM 28930
Como saber mais:
1. Hormônios tireoidianos adicionados ao tratamento têm sido capazes de aliviar as ondas de calor e os suores noturnos que chegavam a durar 20 minutos...
http://hormoniocrescimentoadultos.blogspot.com.
2. Todas estas mulheres tinham valores de TSH na chamada faixa da normalidade...
http://longevidadefutura.blogspot.com
3. O estrogênio é um hormônio “mensageiro” que têm locais de receptores em muitos locais do corpo: útero, vagina, seios, ossos e cérebro são os principais locais...
http://imcobesidade.blogspot.com
AUTORIZADO O USO DOS DIREITOS AUTORAIS COM CITAÇÃO
DOS AUTORES PROSPECTIVOS ET REFERÊNCIA BIBLIOGRÁFICA.
Referências Bibliográficas:
Caio Jr, João Santos, Dr.; Endocrinologista, Neuroendocrinologista, Caio,H. V., Dra. Endocrinologista, Medicina Interna – Van Der Häägen Brazil, São Paulo, Brasil; Warner JO. Review of prescribed treatment for children with asthma in 1990.BMJ1995;311:663–6; Blodget FM, Burgin L, Iezzoni D, et al. Effects of prolonged cortisone therapy on the statural growth, skeletal maturation and metabolic status of children. N Engl J Med1956;254:636–41; Avioli LV. Glucocorticoid effects on statural growth. Br J Rheumatol1993;32(suppl 2):27–30; Crofton PM, Ahmed SF, Wade JC, et al. Effects of intensive chemotherapy on bone and collagen turnover and the growth hormone axis in children with acute lymphoblastic leukemia. J Clin Endocrinol Metab1998;83:3121–9; Ahmed SF, Wallace WH, Crofton PM, et al. Short-term changes in lower leg length in children treated for acute lymphoblastic leukaemia. J Pediatr Endocrinol Metab1999;12:75–80; Ahmed SF, Tucker P, Wallace AM, et al. The effects of prednisolone and dexamethasone on childhood growth and bone turnover during chemotherapy. Clin Endocrinol; Rickers H, Deding A, Christiansen C, et al. Mineral loss in cortical and trabecular bone during high-dose prednisone treatment. Calcif Tis Int1984;36:269–73; Strauss AJ, Su JT, Dalton VM, et al. Bony morbidity in children treated for acute lymphoblastic leukemia. J Clin Oncol2001;19:3066–72; Weinstein RS, Jilka RL, Parfitt AM, et al. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. Potential mechanisms of their deleterious effects on bone. J Clin Invest1998;102:274–82; Hofbauer LC, Gori F, Riggs BL, et al. Stimulation of osteoprotegerin ligand and inhibition of osteoprotegerin production by glucocorticoids in human osteoblastic lineage cells: potential paracrine mechanisms of glucocorticoid-induced osteoporosis.Endocrinology1999;140:4382–9; Hahn TJ, Halstead LR, Teitelbaum SL, et al. Altered mineral metabolism in glucocorticoid-induced osteopenia. Effect of 25-hydroxyvitamin D administration. J Clin Invest1979;64:655–65; Pantelakis SN, Sinaniotis CA, Sbirakis S, et al. Night and day growth hormone levels during treatment with corticosteroids and corticotrophin. Arch Dis Child1972;47:605–8; Hughes NR, Lissett CA, Shalet SM, et al. Growth hormone status following treatment for Cushing's syndrome. Clin Endocrinol1999;51:61–6; Bar-On E, Beckwith JB, Odom LF, et al. Effect of chemotherapy on human growth plate.J Pediatr Orthop1993;13:220–4; Baron J, Huang Z, Oerter KE, et al. Dexamethasone acts locally to inhibit longitudinal bone growth in rabbits. Am J Physiol1992;263:E489–92.
Contato:
Fones: 55 (11) 2371-3337 / (11)5572-4848 / (11) 9.8197-4706
Rua Estela, 515 - Bloco D - 12º andar - Conj 121/122
Paraíso - São Paulo - SP - CEP 04011-002
Email: vanderhaagenbrasil@gmail.com Site Van Der Häägen Brazil
Instagram
João Santos Caio Jr
http://google.com/+JoaoSantosCaioJr
Vídeo
http://youtu.be/woonaiFJQwY